Катионом является частица, формула которой:
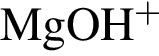
Катионом является частица, формула которой:
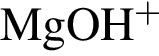
Заряд ядра химического элемента +31. Его относительная атомная масса равна:
Простому веществу НЕ соответствует формула:
Основные свойства гидроксидов монотонно убывают в ряду:
Ионная связь имеется во всех веществах ряда:
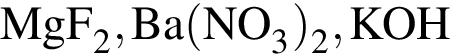
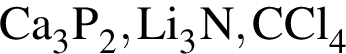
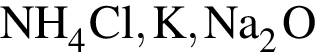
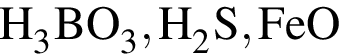
В кристалле 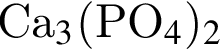 присутствуют связи:
присутствуют связи:
Ионную кристаллическую решётку (н. у.) имеет вещество:
С помощью прибора, изображённого на рисунке, способом вытеснения воздуха с минимальными потерями можно собрать газ (н. у.):
Фенолфталеин приобретает малиновую окраску в растворе, который образуется при растворении в воде оксида:
Для получения никеля из водного раствора сульфата никеля (II) целесообразно использовать металл:
Укажите верное утверждение:
 является слабым электролитом
является слабым электролитомОснования образуются в результате превращений:
а — 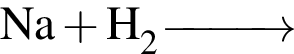
б — 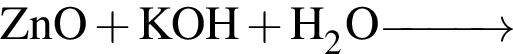
в — 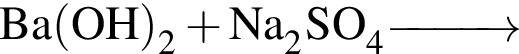
г — 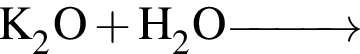
Укажите верное утверждение:
Укажите практически осуществимые реакции (все электролиты взяты в виде разбавленных водных растворов):
а — 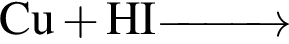
б — 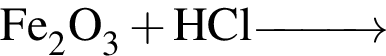
в — 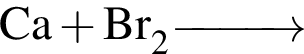
г — 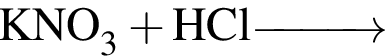
Укажите вещества, водные растворы которых содержат одинаковые ионы (гидролиз веществ и диссоциацию воды не учитывайте):
а)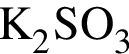 ;
;
б)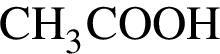 ;
;
в)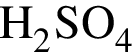 ;
;
г)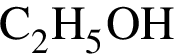 .
.
Разбавленная фосфорная кислота вступает в реакции обмена с веществами:
a — 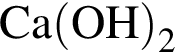
б — ![]()
в — ![]()
г — ![]()
Очистить угарный газ от углекислого можно с помощью водных растворов веществ:
а — 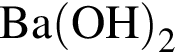
б — 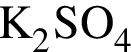
в — 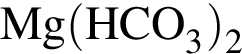
г — 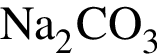
Выберите правильные утверждения:
а) наименьшей теплопроводностью среди металлов обладает серебро
б) железо относят к черным металлам
в) ионы Cu 2+ являются более сильным окислителем в водном растворе, чем ионы Ag+
г) медь растворяется в разбавленной азотной кислоте
Укажите схемы процессов восстановления:
а) 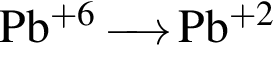
б) 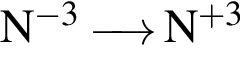
в) 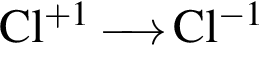
г) 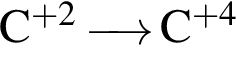
Укажите схему превращения, которое можно осуществить действием водорода на исходное вещество:
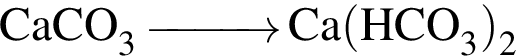

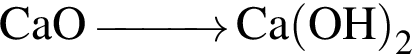

С изменением степени окисления кремния протекают реакции:
а) 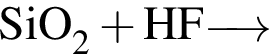
б) 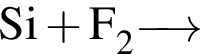
в) 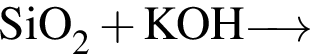
г) 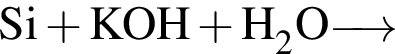
Повышение температуры от 20 °C до 80 °C приведет к увеличению растворимости в воде:
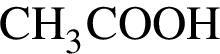
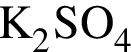
В сосуде объемом 5 дм3 протекает реакция 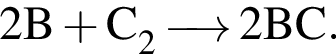 Через 10 с после начала реакции образовалось вещество
Через 10 с после начала реакции образовалось вещество ![]() химическим количеством 20 моль. Средняя скорость (моль/дм3 · с) образования вещества
химическим количеством 20 моль. Средняя скорость (моль/дм3 · с) образования вещества ![]() равна:
равна:
В водном растворе в значительных количествах совместно могут находиться ионы пары:
В пробирку с чистой водой добавили каплю раствора фенолфталеина, а затем несколько капель раствора гидроксида лития. При этом окраска содержимого пробирки менялась в такой последовательности:
Укажите верное утверждение:
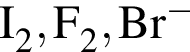 могут проявлять окислительные свойства
могут проявлять окислительные свойства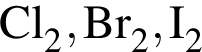 прочность химической связи в молекулах убывает
прочность химической связи в молекулах убывает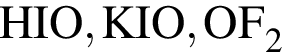 находятся в одинаковой степени окисления
находятся в одинаковой степени окисленияСоединение, модель молекулы которого изображена на рисунке, имеет название:
Назовите по систематической номенклатуре соединение, формула которого:
Укажите количество формул и моделей, соответствующих этину:
Вещество, формула которого представлена ниже, называется:
Укажите схему, отражающую основной процесс, протекающий при термическом крекинге нефти:
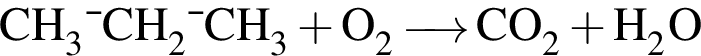
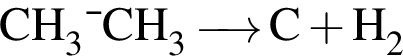
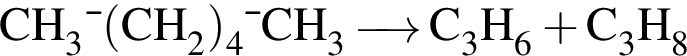
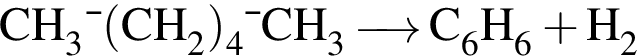
При неполном гидрировании гексина (в молекуле исходного вещества разрывается только одна ![]() -связь) образуется углеводород, химическая формула которого:
-связь) образуется углеводород, химическая формула которого:
Фенол в отличие от уксусной кислоты:
Укажите превращение, основным продуктом которого является карбоновая кислота:
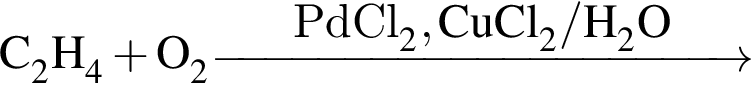
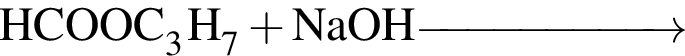
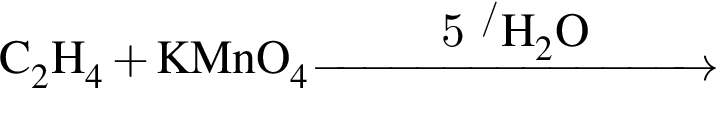
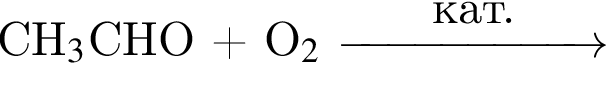
При полном щелочном гидролизе триглицерида получена смесь, состоящая из пальмитата, олеата и бутаноата натрия. Укажите формулу триглицерида:
Укажите формулу ![]() -глюкозы:
-глюкозы:
Сумма коэффициентов перед формулами продуктов в уравнении реакции полного окисления глутаминовой кислоты кислородом равна:
В промышленности реакцию полимеризации используют для получения:
Альдегид А имеет молярную массу меньше 31 г/моль, при гидрировании образует вещество Б молярной массой больше 31 г/моль. При окислении Б может быть получено органическое вещество В, водный раствор которого окрашивает лакмус в красный цвет. При взаимодействии В с гидрокарбонатом калия образуется органическое вещество Г и выделяется газ (н.у) Д. Укажите сумму молярных масс (г/моль) веществ В и Г.
А)
Б)
В)
Г)
1) 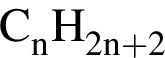
2) ![]()
3) 
4) 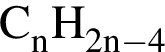
5) 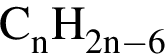
6) 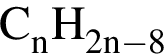
Установите соответствие между схемами превращений и реагентами X и Y. Все реакции протекают в одну стадию.
| Схема превращений | Реагент | |
|---|---|---|
| X | Y | |
| 1) t/кат; | H2O/H, t | |
| 2) H2/t, Ni | NaOH/спирт, t | |
| 3) Br2/CCl4; | H2O | |
| 4) HBr; | NaOH/H2O, t | |
Запишите ответ в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А4Б1. Помните, что некоторые данные правого столбца могут не использоваться вообще.
Определите сумму коэффициентов перед формулами продукта окисления и продукта восстановления в уравнении химической реакции, схема которой
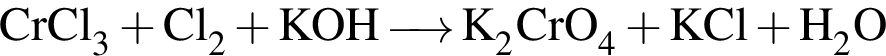
В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
-вещества из пробирок 1 и 4 нейтрализуют друг друга
-при добавлении к содержимому пробирки 2 вещества из пробирки 4 выпадает осадок бурого цвета
-вещества из пробирок 3 и 4 реагируют между собой с образованием осадка, способного растворяться как в кислотах, так и в щелочах.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
А) хлорид алюминия
Б) гидроксид натрия
В) серная кислота
Г) нитрат железа (III)
1
2
3
4
К раствору сульфата меди(II) массой 300 г с массовой долей 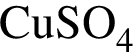 8% добавили медный купорос массой 80 г и перемешали смесь до полного его растворения. Рассчитайте массовую долю (%) соли в полученном растворе.
8% добавили медный купорос массой 80 г и перемешали смесь до полного его растворения. Рассчитайте массовую долю (%) соли в полученном растворе.
Вычислите сумму молярной массы (г/моль) галогенсодержащего вещества X и числа атомов в формульной единице галогенсодержащего вещества Y.
Масса соли, образовавшейся при взаимодействии алюминия с избытком концентрированного раствора гидроксида натрия, составила 2772 г. Рассчитайте химическое количество (моль) электронов, перешедших от атомов алюминия к атомам водорода в результате реакции.
К раствору серной кислоты массой 196 г добавит смесь нитратов бария и свинца(II). За счет протекания реакции масса раствора увеличилась на 7,84 г, а массовые доли кислот в растворе уравнялись. Вычислите массовую долю (%) серной кислоты в исходном растворе.
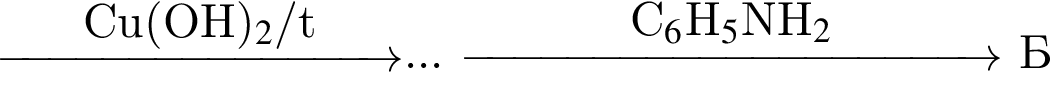
Найдите сумму молярных масс (г/моль) органических веществ ![]() и
и ![]() (вещество
(вещество ![]() имеет немолекулярное строение) в схеме превращений
имеет немолекулярное строение) в схеме превращений

При сгорании водорода массой 8 г выделяется 1144 кДж теплоты, а при сгорании метана массой 8 г выделяется 445 кДж. Рассчитайте количество теплоты (кДж), которая выделится при сгорании в избытке кислорода смеси водорода и метана объемом (н. у.) 8,96 дм3, содержащей 50% метана по объему.
Определите сумму молярных масс (г/моль) серосодержащих веществ Б, E и цинксодержащего вещества Д, полученных в результате превращений (Б является газом)